各种胰腺疾病中,急性胰腺炎(AP)是医院患者死亡的第五大常见原因,全球发病率为每年34/10万 [1, 2];且AP和慢性胰腺炎(CP)相关的全球死亡率分别为每年1.60/10万和0.09/10万 [3],约36%的CP是由AP复发转化而来,尤其在中老年男性中发病率更高[4];胰腺癌(PACA)作为世界上最致命的癌症之一,严重威胁着人类健康,预后极差,五年存活率低至6%[5];每年全球约4.25亿人被糖尿病所困扰[6];除此之外,胰腺创伤(PT)误诊率高、并发症多,现有研究多集中在临床治疗手段改进,但是对于其病情演化的基础研究极少。因此,对于胰腺疾病的早期诊断率的提高和治疗手段的研发将有助改善这一领域的现状。
外泌体(exosome)是细胞间通讯信号的重要载体,在疾病的诊断和治疗中发挥着重要作用。已有研究证实,外泌体通过多种机制参与不同胰腺疾病发展的各个阶段 [7, 8]。此外,外泌体的数量和种类的广泛变化可能预示着胰腺细胞的异常生物学行为。上述现象可作为新的生物标记物或新的治疗靶点用于外泌体研究与推广。
2022年4月8日,英国威廉希尔唯一官网在读硕士研究生韩丽和赵治戎在导师戴睿武教授的指导下,在Stem Cell Research & Therapy(IF:6.83,JCR一区)上发表了题为“Application of exosomes in the diagnosis and treatment of pancreatic diseases”的综述(2022 Apr 8;13(1):153),介绍了外泌体在胰腺疾病诊断和治疗中的作用,并讨论了未来的研究方向和应用前景。此外,4月16日在Digestive Diseases and Sciences(IF:3.18,JCR三区)发表论著“The Effects of Umbilical Cord Mesenchymal Stem Cells on Traumatic Pancreatitis in Rats, Dig Dis Sci. 2022 Apr 16. PMID: 35430701.”,研究发现,脐带间充质干细胞在大鼠创伤性胰腺炎中发挥了良好的治疗效应。

文章首先综述了外泌体作为诊断各种胰腺疾病的特异性生物标记物的作用(Figure 1),例如:血浆来源的外泌体表达的miRNA对AP有较高的诊断价值;外泌体在CP和PACA的鉴别中可能具有高度的特异性;血浆来源的外泌体对糖尿病早期诊断有重要意义等。其次,不同来源的外泌体通过多种机制影响着胰腺疾病的发生发展(Figure 2),例如细胞凋亡、免疫调节、血管生成、细胞迁移和增殖等。
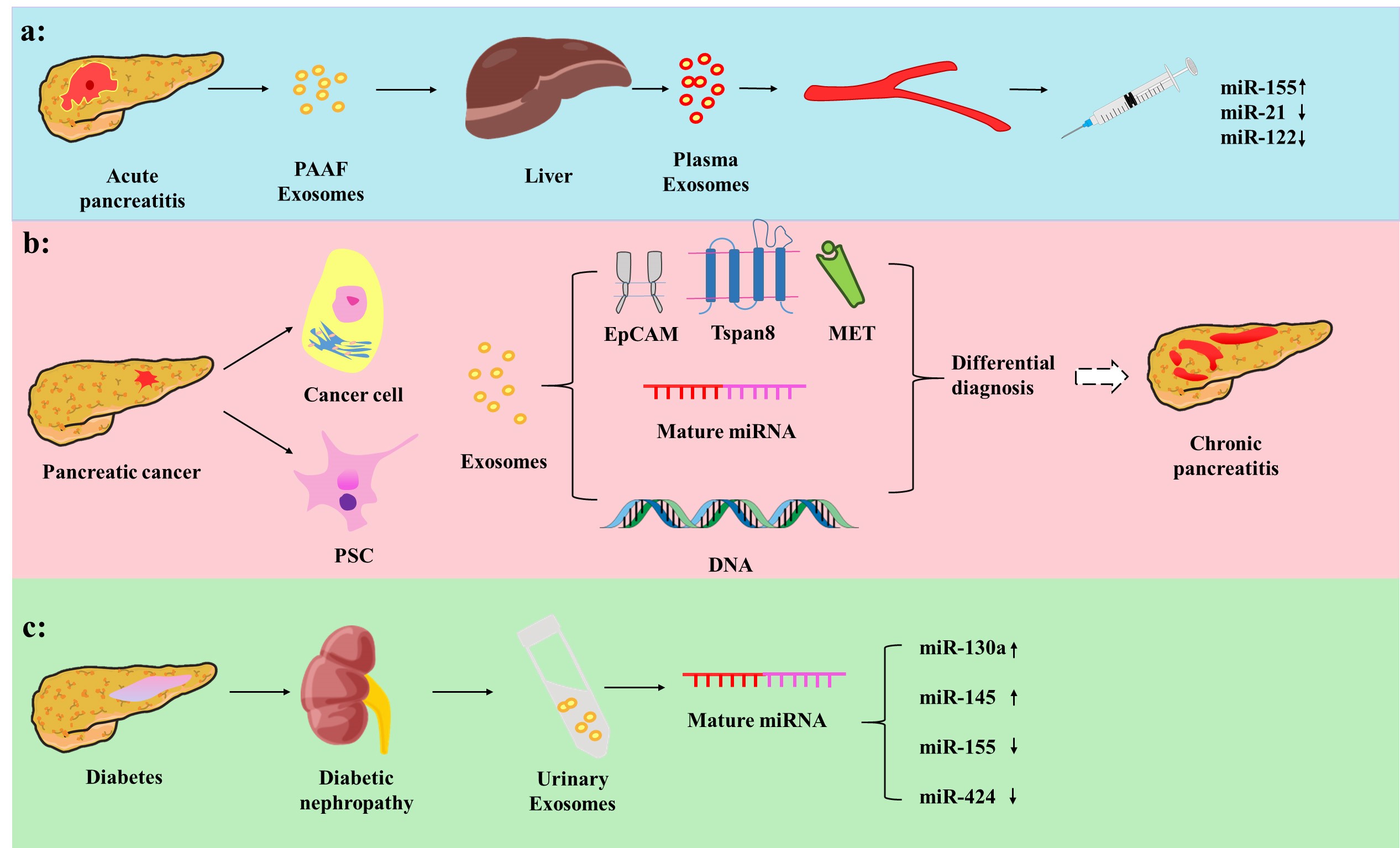
Figure 1
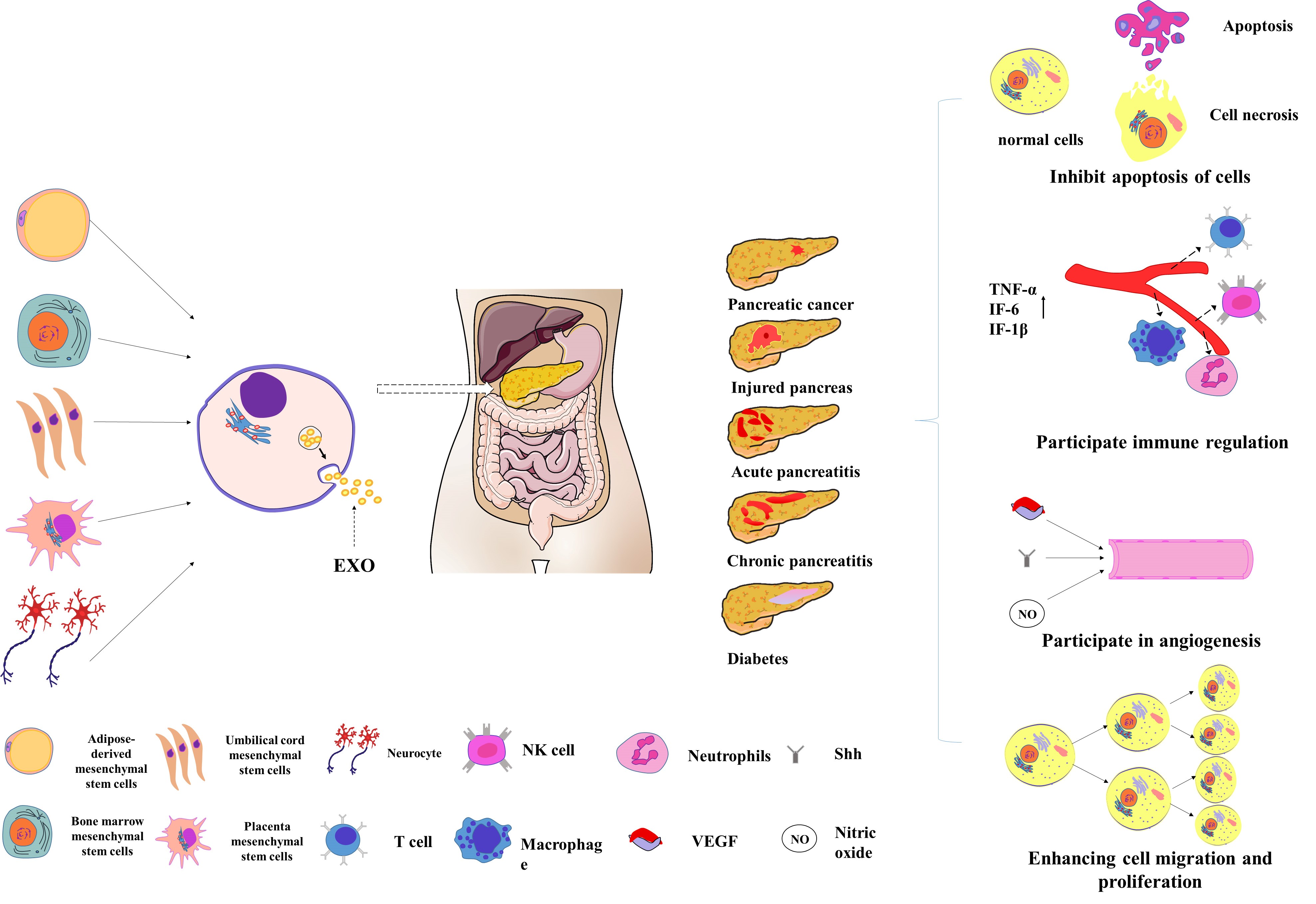
Figure 2
尤其在胰腺创伤这一种特殊类型的胰腺炎症性疾病领域,文章概述了作者团队的既往研究结果。该团队发明的多功能生物撞击仪可完成小动物建模并较好地模拟胰腺创伤伤情,发现干细胞来源的外泌体在胰腺创伤后可发挥与亲本细胞一致的生物学效应,从而修复胰腺损伤;其涉及的分子机制有调节免疫细胞的状态、影响血管生成等。
最后,该文展望了外泌体在胰腺疾病诊断治疗中的研究进展及可能面临的挑战。例如:关于外泌体的提取,目前通常在实验室条件下通过超速离心法分离,在没有实验室的情况下则不易完成。文章提到一种通过芯片从血液中捕获外泌体的简单而新颖的方法[9],将有助于外泌体的临床应用;外泌体的miRNAs检测比传统诊断方法更敏感,有助于早期筛查疾病,以便早期治疗和鉴别诊断提示外泌体在胰腺疾病中的应用可能发挥潜在的社会效益,值得未来深入研究。
韩丽(英国威廉希尔唯一官网在读研究生)、赵治戎(英国威廉希尔唯一官网在读研究生)和杨柯博士为该论文的共同第一作者,戴睿武教授为论文的通讯作者。本研究受到全军重大项目、四川省科技重点研发项目及西部战区总医院科技课题的支持。
戴睿武教授课题组长期从事胰腺疾病的研究,主要侧重于胰腺创伤及修复的临床与基础研究;急性胰腺炎诊断治疗新技术的临床与基础研究;胰腺癌的临床治疗研究;以及肝胆胰外科微创治疗新进展等。欢迎有志于外科基础与临床研究的同学加入,邮箱:dairuiwu@swjtu.edu.cn。
参考文献:
[1] Xiao AY,Tan ML,Wu LM,Asrani VM,Windsor JA,Yadav D, et al.Global incidence and mortality of pancreatic diseases: a systematic review, meta-analysis, and meta-regression of population-based cohort studies. Lancet Gastroenterol Hepatol, 2016. 1(1): p. 45-55 DOI: 10.1016/s2468-1253(16)30004-8.
[2] Pendharkar SA, Mathew J,Petrov MS.Age- and sex-specific prevalence of diabetes associated with diseases of the exocrine pancreas: A population-based study. Dig Liver Dis, 2017. 49(5): p. 540-544 DOI: 10.1016/j.dld.2016.12.010.
[3] Jia YC,Ding YX,Mei WT,Wang YT,Zheng Z,Qu YX, et al.Extracellular vesicles and pancreatitis: mechanisms, status and perspectives. Int J Biol Sci, 2021. 17(2): p. 549-561 DOI: 10.7150/ijbs.54858.
[4] Debi U,Kaur R,Prasad KK,Sinha SK,Sinha A,Singh K.Pancreatic trauma: a concise review. World J Gastroenterol, 2013. 19(47): p. 9003-11 DOI: 10.3748/wjg.v19.i47.9003.
[5] Lowenfels AB,Maisonneuve P,Cavallini G,Ammann RW,Lankisch PG,Andersen JR, et al.Pancreatitis and the risk of pancreatic cancer. International Pancreatitis Study Group. N Engl J Med, 1993. 328(20): p. 1433-7 DOI: 10.1056/nejm199305203282001.
[6] Abulmeaty MMA,Aljuraiban GS,Alaidarous TA,Alkahtani NM.Body Composition and the Components of Metabolic Syndrome in Type 2 Diabetes: The Roles of Disease Duration and Glycemic Control. Diabetes Metab Syndr Obes, 2020. 13: p. 1051-1059 DOI: 10.2147/dmso.S248842.
[7] Valadi H,Ekström K,Bossios A,Sjöstrand M,Lee JJ,Lötvall JO.Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol, 2007. 9(6): p. 654-9 DOI: 10.1038/ncb1596.
[8] Li B,Cao Y,Sun M,Feng H.Expression, regulation, and function of exosome-derived miRNAs in cancer progression and therapy. Faseb j, 2021. 35(10): p. e21916 DOI: 10.1096/fj.202100294RR.
[9] Lewis JM, Vyas AD, Qiu Y, Messer KS, White R, Heller MJ. Integrated analysis of exosomal protein biomarkers on alternating current electrokinetic chips enables rapid detection of pancreatic cancer in patient blood. ACS Nano.2018;12(4):3311–20. https://doi.org/10.1021/acsnano.7b08199.